Gesetze der Gase
Das Thema um die Gase ist eines der Wichtigsten, da sich Gase durch äussere Einwirkungen stark verändern lassen und zu Risiken werden können. Die folgenden Gesetze werden nun die Einwirkungen und Risiken erklären und anhand von Formeln darstellen.
Gesetz von Dalton
John Dalton, englischer Physiker und Chemiker, von 1766-1844. Wissenschaftliche Feststellungen zur Farbenblindheit und Formulierung seines berühmten Gesetzes der Partialdrücke (1801).
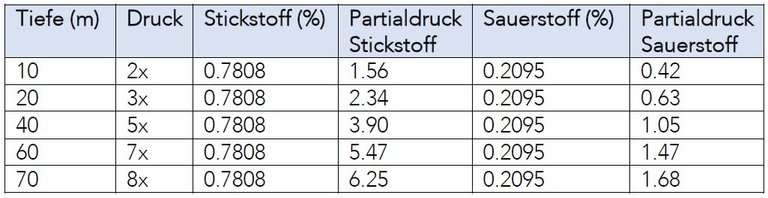
- Der Druck eines Gasgemisches ist gleich der Summe der Teildrücke (Partialdrücke), die jedes einzelne Gas des Gemisches ausübt.
- Der Teildruck eines Gases in einem Gasgemisch entspricht dem Druck, den dieses Gas ausüben würde, wenn es das ganze Volumen allein ausfüllen könnte.
- Der Teildruck eines Gases in einem Gasgemisch ist gleich dem Produkt aus dem Gesamtdruck und dem Prozentsatz, mit dem das Gas im Gemisch vertreten ist.
Daraus ergibt sich folgende Formel:
pTeildruck = PGesamtdruck x Prozentsatz des Gases in der Mischung
→ eine Eigenschaft von Gasen besagt, dass sich jeder Bestandteil eines Gasgemisches so verhält, als wenn er allein wäre
→ der prozentuale Anteil der Gasmischung ändert sich nicht mit steigendem Druck, aber der Partialdruck im Verhältnis zur Druckänderung. (Sauerstoff wird ab 1,6 bar toxisch)
Gesetz von Boyle (Mariotte)
Robert Boyle, irischer Wissenschaftler, von 1627-1691. Edmé Mariotte, französischer Geistlicher, von 1620-1684.
- Sie erkannten beide, dass sich Gase komprimieren lassen
- Bei konstanter Temperatur ist das Volumen einer bestimmten Menge Gas umgekehrt proportional zu seinem Druck
P x V = k oder Druck x Volumen = konstante Menge
Luftballoneffekt, je tiefer man taucht, umso kleiner wird der Ballon.
Feste Lufträume:
- Die Taucherflasche hat ein Volumen von 10l, mit 200 bar gefüllt ergibt das 2.000 Liter Luft unter Normalbedingungen.
Flexible Lufträume:
- Die Lungen und Nebenhöhlen des Tauchers, der Neoprenanzug oder das Jacket stellen solche flexiblen, abgeschlossenen Lufträume dar.
- Das Lungenvolumen beträgt ca. 6 Liter, egal in welcher Tiefe.
- Der Atemregler liefert die dem absoluten Druck angepasste Luftmenge, d.h. in 40 m Tiefe bei 5 bar Umgebungsdruck, 5-mal soviel wie an der Oberfläche. Bei einem Durchschnittsverbrauch von 20 Litern/min. an der Oberfläche entspricht das 100 Litern in 40 Meter Tiefe. 2.000 Liter/100 Liter ergeben 20 min. tauchen.
- Die Lungen sind mit (5 x 6 Liter) 30 Liter Luft gefüllt.
Beim Neopren sind die Bläschen eingeschlossen, der Anzug wird „dünner“.
Gesetz von Henry
William Henry, englischer Physiker und Chemiker, von 1774-1836.
Formulierte (1803) das Gesetz über die Löslichkeit von Gasen in Flüssigkeiten.
- Die Gasmenge, die in einer Flüssigkeit in Lösung geht, steigt mit zunehmendem Druck.
- Umgekehrt kehrt Gas bei Druckverminderung wieder in seine ursprüngliche Form zurück.
- Das klassische Beispiel ist eine Mineralwasserflasche. Das Wasser ist in der unter Druck stehenden frisch gekauften Flasche klar.
Öffnet man die Flasche, der Druck fällt, kehrt das Kohlendioxyd in seinen ursprünglichen gasförmigen Zustand zurück,
es sprudelt aus.
Diese Gesetzmäßigkeit spielt beim Auftauchen,
wenn das Gas nicht wieder abgegeben werden kann, eine entscheidende Rolle und bildet den Grund für Deko-Unfälle.
Während des Tauchganges sättigen sich alle Teile (Gewebe) des Körpers. Hauptsächlich geschieht dies mit Stickstoff.
Die Menge und Geschwindigkeit des Gases ist abhängig von:
- der Tauchtiefe
- der Grundzeit
- der Temperatur
- dem Maß der Bewegung (easy Dive, arbeiten unter Wasser)
- der Art des Gewebes (Blut, Muskeln, Fett, Knochen)
Sättigungszustände
Wie beim Gesetz von Dalton, so wird auch hier Partialdruck oder Teildruck für den Druck als Bezeichnung und damit der Anteil eines gelösten Gases in einer Flüssigkeit verwendet.
Es wird unter folgenden Sättigungszuständen unterschieden:
Sättigung:
Ist erreicht, wenn das Gleichgewicht zwischen absorbiertem und abgegebenem Gas hergestellt ist.
Vom Gewebe kann kein Gas mehr aufgenommen (absorbiert) werden.
Untersättigung:
Der Partialdruck ist geringer als der Druck des freien Gases, es wird weiter Gas absorbiert.
Übersättigung:
Der Partialdruck ist größer als der Druck des freien Gases, es wird wieder Gas abgegeben.
Die Löslichkeit
Zeitfaktor:
Die Sättigung vollzieht sich am Anfang sehr rasch, mit zunehmendem Gleichgewichtszustand verlangsamt sie sich.
Das Entsättigen vollzieht sich auf die entsprechende Weise.
Halbsättigungszeit:
Die Zeit, in der die Hälfte der Gasmenge aufgenommen wurde, die gelöst werden kann.
Beim Blut beträgt die Halbsättigungszeit ≈ 7 Minuten, bei gewissen Muskeln ≈ 60 Minuten.
Kritischer Übersättigungsgrad:
Wenn sich der Partialdruck zu schnell ändert und die Entgasung so schnell vor sich geht, so dass die Bläschen zu groß werden und nicht mehr abtransportiert werden können.
Der kritische Übersättigungsfaktor eines Gewebes ist gleich dem Partialdruck geteilt durch den Umgebungsdruck.